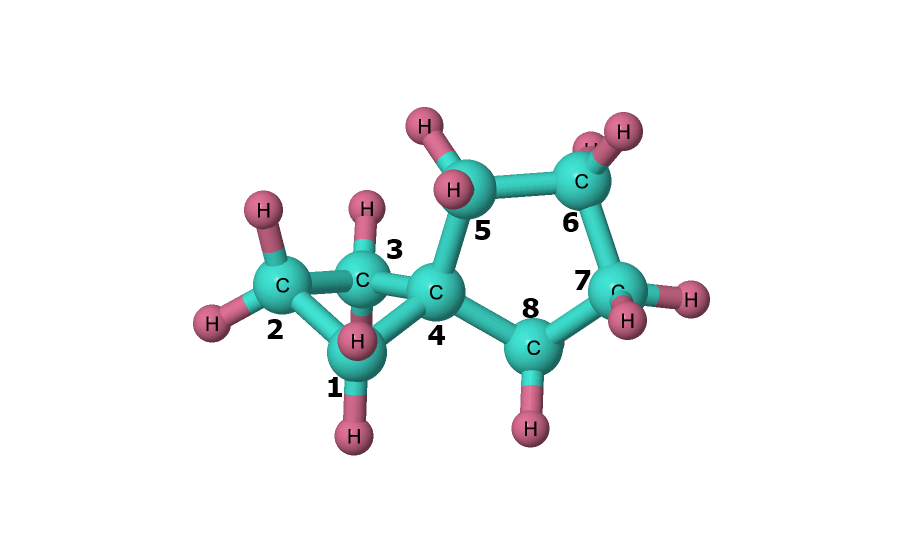
Le spiropentane est un hydrocarbure de formule chimique C5H8. C'est le plus simple des cycloalcanes spiro et des triangulanes,,,. Plusieurs années ont été nécessaires depuis sa découverte en 1887 pour déterminer sa structure,,. Son nom systématique est spiro[2.2]pentane mais, comme il ne peut avoir d'autre spiropentane isomère, son nom simple sans chiffres ni crochets est non ambigu.
Synthèse
Après avoir produit du cyclopropane en faisant réagir du 1,3-dibromopropane avec du zinc métallique finement divisé, Gustavson a tenté la même réaction avec du 2,2-bis(bromoéthyl)-1,3-dibromopropane. La substance de départ s'obtient facilement en faisant réagir du pentaérythritol avec de l'acide bromhydrique. Cela donne un composé de formule C5H8, nommé vinyltriméthylène dans la publication initiale. Fecht postula en 1907 qu'il devait s'agir de spiropentane, isomère du vinylcyclopropane. Un autre indice appuyant la structure de l'hydrocarbure vient du fait qu'il a également pu être obtenu à partir de 1,1-bis(bromoéthyl)cyclopropane.
Le spiropentane est difficile à séparer des autres produits de réaction, et les premières procédures aboutissaient à des mélanges impurs. Des décennies plus tard, la méthode de production a été améliorée. L'hydrocarbure spiro peut être séparé des sous-produits (2-méthyl-1-butène, 1,1-diméthylcyclopropane, méthylènecyclobutane) par distillation.
Propriétés
La caractérisation structurelle par diffraction électronique a montré que la longueur des liaisons C–C n'est pas la même avec l'atome de carbone quaternaire (centre spiro) qu'entre les groupes méthylène : elle vaut 146,9 pm avec l'atome central contre 151,9 pm entre les groupes CH2–CH2. L'angle C–C–C au niveau du centre spiro vaut 62,2°, ce qui est plus élevé que dans le cyclopropane.
Le chauffage de molécules de spiropentane marquées avec des atomes de deutérium permet de mettre en évidence une topomérisation ou « stéréomutation » semblable à celle du cyclopropane : le cis-1,2-dideutériospiropentane s'équilibre ainsi avec le trans-1,2-dideutériospiropentane.
Gustavson a rapporté en 1896 que le chauffage du spiropentane à 200 °C le convertissait en d'autres hydrocarbures. Une thermolyse en phase gazeuse de 360 à 410 °C conduit à une expansion du cycle en l'isomère méthylènecyclobutane, ainsi que les produits de fragmentation éthylène et propadiène. Il est probable que la liaison la plus longue — et la plus faible — soit rompue en premier, formant un intermédiaire diradical.
Notes et références
- Portail de la chimie